I. TABLA DE VALENCIAS
Valencia es la capacidad que posee un elemento para combinarse con otro. El concepto de valencia es limitado y no explica muchas fórmulas de compuestos.
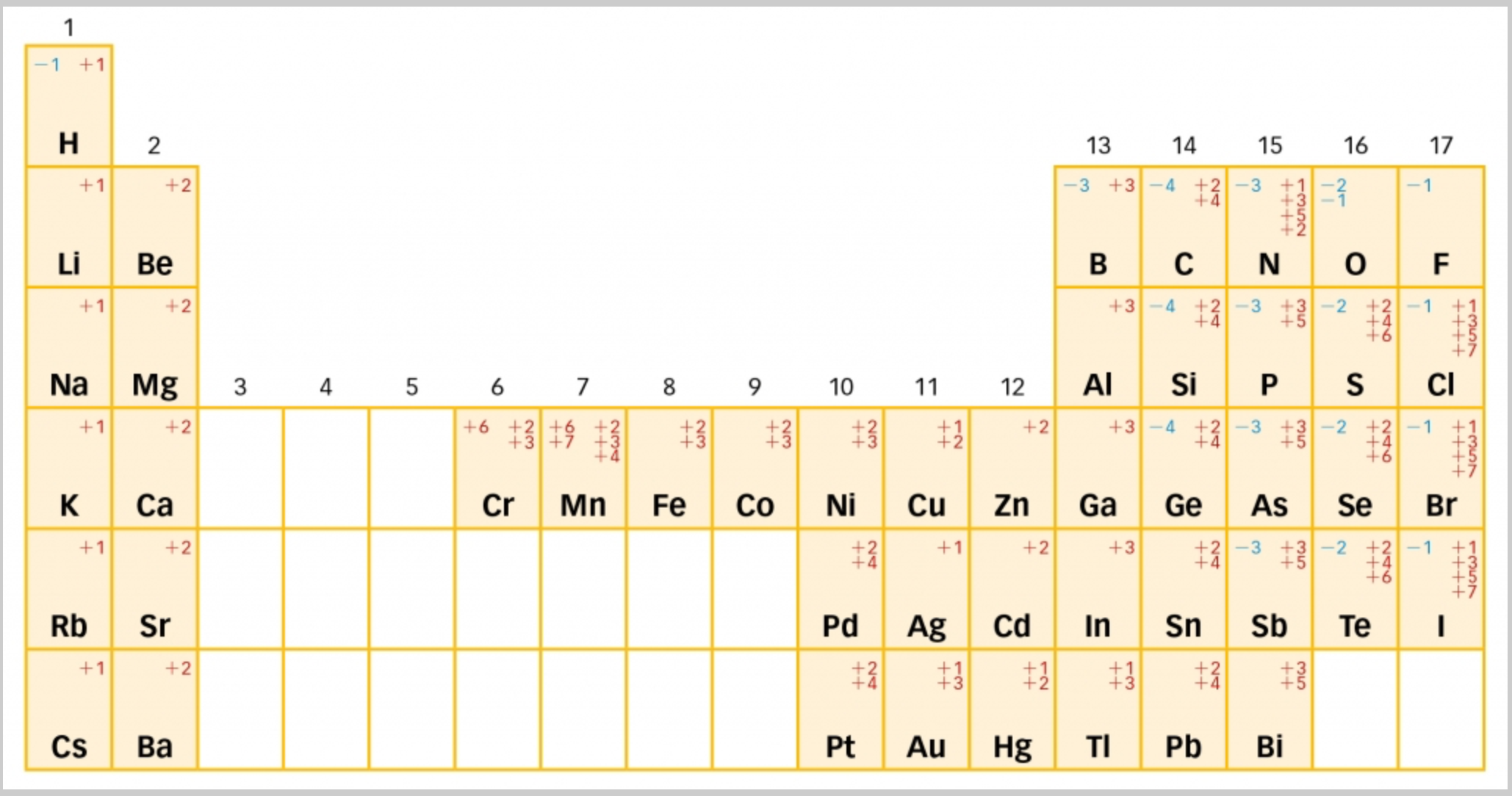
El número de oxidación es el número de electrones que un átomo capta o cede (total o parcialmente) al formar un compuesto. Es negativo si gana electrones y positivo si los pierde.
Los símbolos y las valencias de los elementos más importantes aparecen en tabla adjunta.

Situándolos en el Sistema Periódico quedarían de la siguiente forma:
II. NORMAS GENERALES
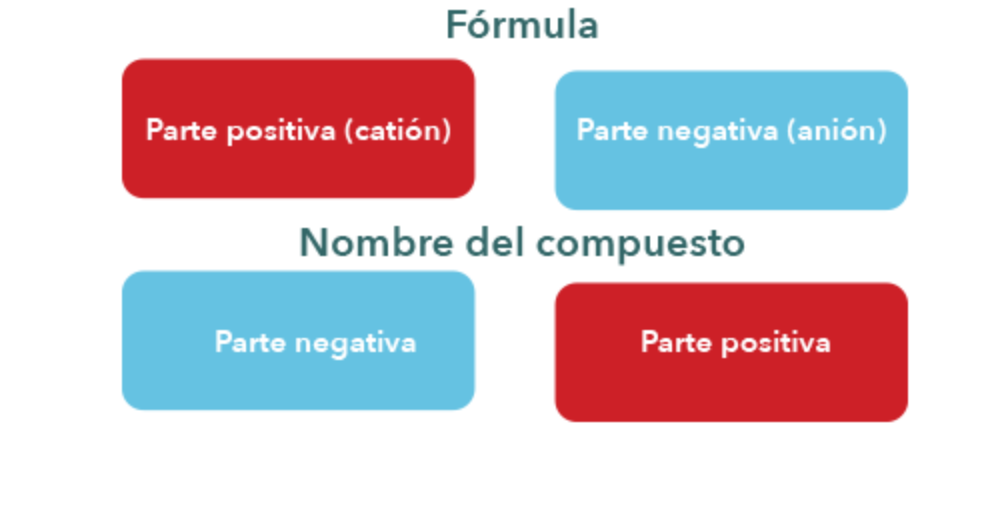
Para escribir una fórmula química, se escriben los símbolos de los elementos que forman la molécula de ese cuerpo, con unos subíndices que nos indican el nº de átomos de los mismos que entran a formar parte de la molécula en cuestión.
- El nombre, consta generalmente de dos palabras: una, que suele ser la 1ª, indica el nombre genérico del grupo al que pertenece el compuesto (ácido, óxido...) y la 2ª indica de cual de los componentes se trata (carbonoso, sulfúrico...).
- Los compuestos son eléctricamente neutros, es decir, la suma de las valencias positivas debe coincidir con la suma de las valencias negativas.
- Los metales actúan siempre con valencia positiva
- En toda fórmula química, la parte electropositiva se escribe a la izquierda y la parte electronegativa a la derecha.
- Las fórmulas químicas se leen al revés de como se escriben (de detrás hacia delante)
-
III. TIPOS DE NOMENCLATURAS
En general, se utilizan tres tipos de normas para la nomenclatura. Se deben seguir las normas de la IUPAC (Unión Internacional de Química Pura y Aplicada):
a) Tradicional, cuyo elemento más característico, como se verá, es la utilización de los sufijos hipo-oso, - oso , ico, per-ico para diferenciar entre la valencia menor y mayor del elemento que interviene en la fórmula.
b) De Stock, en la que se nombra la parte electronegativa seguida de la electropositiva, añadiendo, entre paréntesis y en números romanos, la valencia del elemento principal, en el caso de que esta no sea única.
c) Sistemática (la recomendada por la IUPAC), en la que se utilizan los prefijos (mono, di, tri, tetra, penta, hexa, hepta), para indicar en qué proporción entran los elementos que forman un compuesto.
IV. IONES MONOATÓMICOS
Un ión, es un átomo con carga (es decir, que ha perdido o ganado electrones). Si su carga es positiva, se llama catión, y si es negativa, anión.
Los cationes se nombran anteponiendo la palabra ión o catión al nombre del elemento. En el caso de que el elemento pueda formar varios iones, se añade, al nombre del elemento el número que indica la carga (en nº romanos y entre paréntesis).
El símbolo del elemento se acompaña de un superíndice con el valor de la carga seguido del signo más. En+
Ejemplo: Na+ = catión sodio // Fe2+ = catión hierro (II)
En la nomenclatura tradicional se usan las terminaciones oso e ico para la menor o la mayor valencia, en el caso de que existan dos valencias
Ejemplo: Cu+1 = cuproso // Cu2+ = cúprico
Los aniones se nombran haciendo terminar en uro el nombre del elemento (una excepción es la del oxígeno, cuyo ión se llama óxido)
El símbolo del elemento se acompaña de un superíndice con el valor de la carga seguido del signo menos. En–
Ejemplo: O2- = óxido // S2- = sulfuro
ÓXIDOS
Son compuestos formados por la combinación del oxígeno con otro elemento. Su fórmula general es E2 On indicando n la valencia positiva del elemento en cuestión. Si n fuera par, los subíndices de la fórmula se deberán simplificar.
El elemento en cuestión puede ser un metal o un no metal. En la nomenclatura tradicional, a los óxidos de no metal, se les llamaba anhídridos, en la actualidad, esta nomenclatura está en desuso.
|
TRADICIONAL
(en desuso)
|
STOCK
|
SISTEMATIZADA O ESTEQUIOMÉTRICA
|
|
F.- E+n + O2- E2On se intercambian las valencias que pasan a ser subíndices (sin el signo).
En el caso de poderse simplificar los subíndices, hay que simplificarlos (esto sucede si n es par).
|
F.- Se sigue el mismo sistema que el utilizado en el método tradicional.
|
F.- Se formula directamente a partir del nombre, poniendo los elementos que lo forman en orden inverso a como han sido nombrados, actuando como subíndices los numerales que se indiquen
|
|
|
|
Aquí no hay que simplificar, ya que sale como corresponde.
|
|
N.- Óxido del nombre del elemento terminado en oso (si se utiliza con la menor valencia) o en ico (si se utiliza con la mayor valencia). En el caso de que el elemento sólo tuviese una valencia, se nombrará como óxido de el elemento que fuera.
|
N.- Óxido de elemento (valencia del elemento en números romanos) En el caso de que el elemento sólo tenga una valencia, no se pone nada entre paréntesis
|
N.- Numeral óxido de numeral nombre del elemento. El prefijo mono se admite si el elemento E tiene más de una valencia.
|
|
Si un elemento tuviera más de dos valencias, como es el caso del cloro, a la hora de nombrarlos, se sigue el siguiente criterio:
|
|
|
|
menor valencia: óxido hipo---oso
|
|
|
|
siguiente : óxido ---------oso
|
|
|
|
siguiente : óxido ---------ico
|
|
|
|
mayor : óxido per-----ico
|
|
|
|
Ejemplos.-
|
Ejemplos.-
|
Ejemplos.-
|
|
Óxido cúproso: Cu+1 + O2- Cu2O
|
Óxido de cobre (I)
|
Óxido de dicobre: Cu2O
|
|
Óxido cúprico: Cu+2 + O2-Cu2O2
y como los subíndices son simplificables, quedará CuO
|
Óxido de cobre (II)
|
Monóxido de cobre: CuO
|
|
Óxido de aluminio: Al+3 + O2- Al2O3
|
Óxido de aluminio
|
Trióxido de dialuminio: Al2O3
|
|
Óxido hipocloroso: Cl+1 + O2- Cl2O
|
Óxido de cloro (I)
|
Monóxido de dicloro: Cl2O
|
|
Óxido cloroso: Cl3+ + O2- Cl2O3
|
Óxido de cloro (III)
|
Trióxido de dicloro: Cl2O3
|
|
Óxido clórico: Cl5+ + O2- Cl2O5
|
Óxido de cloro (V)
|
Pentaóxido de dicloro:Cl2O5
|
|
Óxido perclórico: Cl7+ + O2- Cl2O7
|
Óxido de cloro (VII)
|
Heptaóxido de dicloro: Cl2O7
|
|
A los óxidos de no metal, se les llama también anhídridos, aunque este nombre está en creciente desuso.
|
|
|
Son los compuestos ternarios (formados por tres elementos distintos) más sencillos. Se forman por la combinación de un metal con el grupo “hidróxido” (OH)1-Su fórmula general es del tipo M (OH) n donde la n es la valencia del metal. También se les suele denominar “bases” debido al carácter básico que presentan al reaccionar con los iones hidrógeno.
Se nombran siempre con la palabra hidróxido seguida del nombre del metal (con ciertas características según la nomenclatura que se utilice.
|
TRADICIONAL
|
STOCK
|
SISTEMATIZADA
|
|
F.- M+n + (OH)1- M(OH)n Se intercambian las valencias que pasan a ser subíndices. Aquí no hay posibilidad de simplificación.
|
F.- Se sigue el mismo sistema que el utilizado en el método tradicional.
|
F.- Se forma directamente a partir del nombre, poniendo los elementos que lo forman en orden inverso a como han sido nombrados, actuando como subíndices los numerales que se indiquen.
|
|
N.- Hidróxido del nombre del metal terminado en oso o en ico según el criterio ya explicado.
|
N.- Hidróxido del nombre del metal seguido entre paréntesis de su valencia en números romanos. Si el metal sólo tuviese una valencia, no se pone nada entre paréntesis.
|
N.- Numeral, seguido de la palabra hidróxido del metal que sea. El prefijo mono se admite si el metal tiene más de una valencia
|
|
Ejemplos.-
|
Ejemplos.-
|
Ejemplos.-
|
|
Hidróxido férrico: Fe+3 + (OH)1- Fe(OH)3
|
Hidróxido de hierro (III)
|
Trihidróxido de hierro: Fe(OH)3
|
|
Hidróxido ferroso: Fe+2 + (OH)1- Fe(OH)2
|
Hidróxido de hierro (II)
|
Dihidróxido de hierro: Fe(OH)2
|
|
Hidróx. de calcio: Ca+2 + (OH)1- Ca(OH)2
|
Hidróxido de calcio
|
Dihidróxido de calcio: Ca(OH)2
|
Son compuestos formados por la combinación de un elemento con el hidrógeno. Varias clases.
-
Hidruros metálicos.-
Están formados por la combinación de un metal con el hidrógeno. Al ser el metal siempre electropositivo, este es el único caso en el que el hidrógeno actúa con nº de oxidación 1-.
Su fórmula general es de la forma M Hn donde la n coincide con la valencia del metal.
Se nombran siempre con la palabra hidruro seguido del nombre del metal con ciertas características según la nomenclatura que se utilice.
|
TRADICIONAL (en desuso)
|
STOCK
|
SISTEMATIZADA
|
|
F.- M+n + H1- MHn Las valencias se intercambian pasando a ser subíndices.
Aquí no hay posibilidad de simplificación pues el subíndice del metal siempre será la unidad.
|
F.- Se sigue el mismo sistema que el utilizado en el método tradicional.
|
F.- Se formula directamente a partir del nombre, poniendo los elementos que lo forman en orden inverso a como han sido nombrados, actuando como subíndices los numerales que se indiquen.
|
|
N.- Hidruro del nombre del metal terminado en oso (si se utiliza con la menor valencia) o en ico (si se utiliza con la mayor valencia). En el caso de que el metal tuviese sólo una valencia, se nombrará como hidruro de el metal que fuera.
|
N.- Hidruro de el nombre del metal que fuese seguido de su valencia en números romanos , colocada entre paréntesis. En caso de que el metal sólo tuviera una valencia, no se pone nada entre paréntesis.
|
N.- Numeral, seguido de la palabra hidruro del metal que sea. El prefijo mono se admite si el metal tiene más de una valencia.
|
|
Ejemplos.-
|
Ejemplos.-
|
Ejemplos.-
|
|
Hidruro cúprico: Cu+2 + H1- CuH2
|
Hidruro de cobre (II)
|
Dihidruro de cobre: CuH2
|
|
Hidruro cuproso: Cu+1 + H1- CuH
|
Hidruro de cobre (I)
|
Monohidruro de cobre: CuH
|
|
Hidruro de aluminio: Al+3 + H1- AlH3
|
Hidruro de aluminio
|
Trihidruro de aluminio: AlH3
|
-
Hidruros de no metal.-
Se forman por la combinación de un no metal con el hidrógeno. En este caso el hidrógeno actúa con valencia +1 por lo que los no metales deberán actuar con valencia negativa.
Pueden ser de dos clases:
b-1.- Hidrácidos, que son unos hidruros de no metal que al disolverse en agua presentan carácter (propiedades) ácidas. Se producen al combinarse el H (+1) con uno de los elementos siguientes: F, Cl, Br, I, S, Se, Te, (todos estos con valencias negativas).
|
TRADICIONAL
|
SISTEMATIZADA
|
|
F.- H+1 + NMn- Hn NM Se intercambian las valencias que pasan a ser subíndices (sin el signo).
Aquí tampoco hay posibilidad de simplificación
|
F.- Se formula de la misma forma que en el caso de la tradicional. (Es interesante tener presente lo que ya se ha indicado de que todo elemento terminado en uro actúa siempre con valencia -, pues se trata de un anión).
|
|
N.- Ácido de el nombre del no metal que sea terminado en hídrico (cuando está en disolución)
|
N.—No metal terminado en uro de hidrógeno.
|
|
Ejemplos.-
|
Ejemplos.-
|
|
Ácido clorhídrico: H+1 + Cl1- HCl
|
Cloruro de hidrógeno: H+1 + Cl1- HCl
|
|
Ácido sulfhídrico: H+1 + S2- H2S
|
Sulfuro de hidrógeno: H+1 + S2- H2S
|
b-2.- Hidruros de no metal sin carácter o propiedades ácidas.- En este grupo están todos los restantes hidruros no metálicos. El hidrógeno se une a no metales de electronegatividad semejante a la suya, con lo que los enlaces producidos son de tipo covalente y muy poco polares (lo que explica la falta de carácter ácido de estos compuestos).
Aquí el H se suele escribir a la derecha (excepto en el agua), y la mayoría de los compuestos tienen nombres propios aunque también puede utilizarse la sistemática:
H2O = agua NH3 = amoniaco PH3 = fosfano AsH3 = arsano
CH4 = metano SiH4 = silano BH3 = borano SbH3 = estibano
-
Hidrácidos
Ya se han explicado cuando se han visto los hidruros de no metal.
-
Oxácidos
Su fórmula general es: H NM O
Normalmente se forman al combinar con agua un óxido de no metal
|
TRADICIONAL
|
SISTEMÁTICA
|
|
F.- Se pueden formular a partir de los óxidos de un no metal, añadiéndoles una (en ocasiones más) molécula de agua.
|
F.- Se formulan directamente a partir del nombre, teniendo en cuenta que el orden es siempre el inverso a como se escriben, y poniendo debajo de cada elemento el número de átomos que lo forman, que nos viene indicado, por un numeral (en el caso del oxígeno o del no metal).
|
|
N.- Ácido, nombre del no metal, terminado en oso o ico. Delante de la palabra ácido puede llevar un prefijo (hipo, per) o bien (meta, piro u orto en el caso de los poli hidratados)
|
N.- Numeral oxo numeral no metal terminado en ato (valencia del no metal en nº romanos) de hidrógeno.
|
|
Ejemplos.-
|
Ejemplos.-
|
|
Ácido carbónico.- Proviene de añadirle agua al óxido carbónico.
|
Trioxocarbonato (IV) de hidrógeno
|
|
Óxido carbónico: C4+ + O2- C2O4 CO2
Una vez formulado el óxido carbónico le añadimos una molécula de agua: CO2 + H2O H2CO3
|
En primer lugar colocaremos los símbolos de los elementos de que consta: HCO. El subíndice que llevará el no metal es 1 (no se pone) salvo en el caso de que por medio de un numeral se me indique lo contrario. El oxígeno tendrá de subíndice 3 según me indica su numeral.
Tendremos ahora HCO3
Para calcular el subíndice del H hay que pensar que la molécula es neutra (nº valencias + = nº valencias -)
Cada molécula de O tiene de valencia 2- y como hay 3, el nº de cargas - será 3x2=6-
El C tiene de valencia +4. Como 4+ se compensan con 4-, aún quedarán 2- por compensarse, por lo que el H debe aportar un total de 2+. Si cada átomo de H aporta 1+, necesitaremos 2 átomos de H. Quedará: H2CO3
H C O3
⇓ ⇓
2 4+ 2-
⇑ ⇓ ⇓ 3 átomos que hay x (2-)
2+ 4+ 6-
|
|
Ácido perclórico: Proviene de añadir agua al óxido perclórico.
Óxido perclórico: Cl+7 + O2- Cl2O7
Cl2O7 + H2O H2Cl2O8 HClO4
|
Tetraoxoclorato (VII) de hidrógeno
a) H Cl O
b) H Cl O4
c) H Cl O4
⇓ ⇓
1 7+ 2-
⇑ ⇓ ⇓ 4 x (2-) = 8-
1 7+ 8-
|
Otra forma de formular los oxácidos (en la nomenclatura tradicional)
Se basa en que todos los oxácidos responden a la fórmula general H NM O.
El no metal, actuará con una valencia que, o es un nº par o bien es impar.
-
Si es par, el subíndice del no metal será 1; el del hidrógeno será 2, y para hallar el del oxígeno, sumaré un 2 a la valencia del no metal y dividiré el resultado por 2.
-
Si es impar, el subíndice del no metal será 1; el del hidrógeno será 1, y para hallar el del oxígeno, sumaré un 1 a la valencia del no metal y dividiré el resultado por 2.
Ejemplos.-
-
Ácido carbónico: Al ser un oxácido estará formado por H NM O. En este caso, el no metal será el carbono C, y al terminar el ácido en ico, significa que el carbono actúa con la mayor valencia, en este caso en 4+. Al ser este un nº par, el subíndice del H será un 2 (el no metal tiene siempre como subíndice un 1). El subíndice del oxígeno será, (2+4)/2=3 H2CO3
-
Ácido perclórico: Este ácido estará compuesto por H Cl O. Como en este caso el cloro actúa con valencia 7+, y este es un nº impar, el subíndice del hidrógeno será un 1; el del no metal siempre es 1, y el del oxígeno será: (1+7)/2=4 HClO4
-
Oxácidos polihidratados
En el caso de los oxácidos de fósforo, arsénico y antimonio, se pueden obtener sumando más de una molécula de agua a los óxidos de no metal correspondientes. Los ácidos poli hidratados no se pueden hacer por el método abreviado, excepto los que tienen el prefijo META
óxido ----- + 1 H2O ácido META -----
óxido ----- + 2 H2O ácido PIRO -----
óxido ----- + 3 H2O ácido ORTO -----
Ejemplo.- Ácido ortofosfórico .- Se formará añadiendo 3 moléculas de agua al óxido fosfórico.
P+5 + O2- P2O5 /// P2O5 + 3 H2O H6P2O8 H3PO4
Se forman al sustituir el hidrógeno del ácido por metales. Se clasifican en:
a)Sales ternarias
Su fórmula general es del tipo M NM O.
Se forman al sustituir el hidrógeno de un ácido oxácido por un metal.
|
TRADICIONAL
|
SISTEMÁTICA
|
|
F.- Se formulan a partir de los oxácido, sustituyendo el hidrógeno por metales.
N.- Puede haber un prefijo, a continuación, el nombre del no metal terminado en ito o ato, seguido del nombre del metal terminado en oso o ico.
Para saber si el no metal debe terminar en ito o en ato, hay que ver de qué ácido proviene la sal:
|
F.- Se formula directamente a partir del nombre, teniendo en cuenta que el orden es siempre el contrario a como se escriben, y poniendo bajo de cada elemento el número de átomos que lo forman. El subíndice del oxígeno y del no metal, nos viene indicado por un numeral. En los ejemplos se indica exactamente los pasos a seguir.
N.- Numeral oxo numeral no metal terminado en ato (valencia del no metal en nº romanos) de metal seguido de (valencia).
|
|
Ejemplos.-
|
Ejemplos.-
|
|
Sulfato de sodio.- Esta sal, como termina en ato, provendrá de un ácido terminado en ico, es decir, del ácido sulfúrico = H2SO4
Una vez formulado el ácido le quitamos el hidrógeno con lo que queda (SO4)2- La valencia 2- corresponde al nº de hidrógenos que hemos quitado y que ahora vamos a sustituir por el metal correspondiente (en este caso, nos dicen por el sodio). Quedará:
Na1+ + (SO4)2- Na2 S O4 Se intercambian tal y como se hacía en casos anteriores.
|
Tetra oxo sulfato (VI) de sodio:
a) Colocamos los elementos con los subíndices correspondientes, excepto el metal
S O4
b) Calculamos la valencia del grupo de la siguiente forma:
S O4
⇑ ⇓
2-
⇓ 4 átomos x (2-) = 8-
6+ 8- Valencia del grupo = 2-
c) Ponemos el metal con su valencia, el grupo con la suya e intercambiamos:
Na1+ + (SO4)2- Na2 S O4
|
|
Nitrito férrico.- Lo podemos formar a partir del ácido nítroso = HNO2
Fe3+ + (NO2)1- Fe(NO2)3
|
Dioxonitrato (III) de hierro (III)
a) N O2
b) N O2
⇓ ⇓
2-
⇓
3+ 4- 1-
c) Fe3+ + (NO2)1- Fe(NO2)3
|
|
Pirofosfato plumboso.- Proviene del ácido pirofosfórico, (que se obtiene a partir del óxido fosfórico + 2 moléculas de agua).
a) óxido fosfórico P5+ + O2- P2O5
b) ácido pirofosfórico P2O5 + 2 H2O H4P2O7
c) pirofosfato plumboso Pb+2 + (P2O7)4- Pb4(P2O7)2 y simplificando queda Pb2P2O7
|
Heptaoxodifosfato (V) de plomo (II)
Siguiendo los pasos vistos anteriormente, procura formularlo tú.
|
b) Sales binarias
Su fórmula general es del tipo M NM
|
TRADICIONAL (en desuso)
|
SISTEMÁTICA
|
|
F.- Para formularlos se combina el metal, con su valencia correspondiente, con el no metal, con valencia negativa: M+n + NMm- MmNMn
|
F.- Se formula igual que en el caso del método tradicional
|
|
N.- No metal uro metal terminado en oso o ico
|
N.- No metal uro de metal (valencia)
|
|
Ejemplos.-
|
Ejemplos.-
|
|
Sulfuro férrico: Fe+3 + S2- Fe2S3
Bromuro cobaltoso: Co+2 + Br1- CoBr2
|
Sulfuro de hierro (III): Igual que lo anterior
Bromuro de cobalto (II): “ “ “
|
-
Sales ácidas
Se obtienen al sustituir parte del hidrógeno de los ácidos por metales. Hay de dos clases: ternarias cuando proceden de un ácido hidrácido y cuaternarias, si proceden de un oxácido.
c-1) Sales ácidas ternarias
Proceden de un ácido hidrácido. Su fórmula general es del estilo M H NM
|
TRADICIONAL (en desuso)
|
SISTEMÁTICA
|
|
F.- Una forma de formularlas, quizás más lenta, sería formular, en primer lugar, el ácido del que proviene, teniendo en cuenta las terminaciones :
ácido sal
uro (hídrico) uro
N.- Se puede nombrar de dos formas:
bi no metal uro metal oso o ico
no metal uro ácido metal oso o ico
|
F.- Se escriben los componentes del compuesto en el orden indicado M (H NM). La valencia del metal será el subíndice que se deba poner en el paréntesis.
N.- hidrógeno no metal uro de metal (valencia)
|
|
Ejemplos.-
|
Ejemplos.-
|
|
Bisulfuro férrico (sulfuro ácido férrico):
Al terminar en uro, proviene del ácido sulfhídrico o sulfuro de hidrógeno: H2S
El prefijo bi indica que a la hora de formar la sal sólo se le debe sustituir por un metal uno de los hidrógenos, es decir, al quitar uno, nos quedará: (HS)1- . El grupo actúa con valencia 1- (coincide con el nº de hidrógenos que hemos quitado).
Ahora pondremos el metal y el grupo que nos ha quedado e intercambiaremos las valencias como sigue:
Fe+3 + (HS)1- Fe (HS)3
|
Hidrógeno sulfuro de hierro (III)
a) Fe ( H S ) Como el hierro actúa con valencia +3, ese número será el subíndice del grupo (HS).
b) Fe (HS)3
|
c-2) Sales ácidas cuaternarias
Provienen de los ácidos oxácidos y se forman al sustituir parte de los hidrógenos que contienen por metales.
Su fórmula general es del tipo M (H NM O)
|
TRADICIONAL
|
SISTEMÁTICA
|
|
F.- En primer lugar se formula el ácido del que proviene teniendo en cuenta las terminaciones. A continuación se le quita parte de los hidrógenos y se halla la valencia del grupo resultante. Se coloca el metal con su valencia y el grupo con la suya y se intercambian
Si se pudiera, habría que simplificar.
N.- R bi no metal ito /ato metal oso/ico
R es un prefijo (di, tri) que puede llevar
También se podría nombrar:
No metal ito/ato R ácido metal oso/ico
|
F.- Se escriben los componentes del compuesto en el orden siguiente M (H NM O ). El nº que indique la valencia del metal corresponderá al subíndice del grupo, y el nº que indique la valencia del grupo corresponderá al subíndice del metal. Si se pudiera, hay que simplificar.
N.- numeral hidrógeno numeral oxo numeral no metal ato (valencia) de metal (valencia)
|
|
Ejemplos.-
|
Ejemplos.-
|
|
Bisulfato férrico (sulfato ácido férrico)
El bisulfato, por terminar en ato, proviene de un ácido terminado en ico: ácido sulfúrico: H2SO4
El prefijo bi indica que de los dos hidrógenos que contiene se le debe quitar uno y dejar el otro, con lo qie quedará: (HSO4)1-. La valencia 1- del grupo, coincide con el nº de átomos de hidrógeno que hemos quitado.
Fe3+ + (HSO4)1- Fe (HSO4)3
|
Hidrógeno tetra oxo sulfato (VI) de hierro (III)
a) Colocamos los elementos con los subíndices que los numerales del hidrógeno, oxígeno y no metal nos indican: Fe (H S O4 )
b) Obtenemos la valencia del grupo H S O4
⇓ ⇓ ⇓
+1 +6 -2
⇓ ⇓ ⇓ 4x2=8
Valencia del grupo = 1- +1 +6 -8
c) Fe3+ + (H S O4 ) 1- Fe ( H S O4 )3
|
EJERCICIOS
Formular los compuestos siguientes:
-
Óxido ferroso
-
Óxido cúprico
-
Óxido de cinc
-
Óxido estánnico
-
Óxido de potasio
-
Óxido clórico
-
Óxido perbrómico
-
Óxido carbónico
-
Óxido plumboso
-
Óxido áurico
-
Óxido nítrico
-
Óxido hipoyodoso
-
Óxido de niquel (III)
-
Óxido de calcio
-
Óxido de silicio (IV)
-
Óxido de cloro (VII)
-
Óxido de cadmio
-
Óxido de fósforo (III)
-
Óxido de teluro (IV)
-
Monóxido de carbono
-
Trióxido de dicobalto
-
Pentaóxido de dibromo
-
Dióxido de platino
-
Heptaóxido de dicloro
-
Hidróxido férrico
-
Hidróxido platinoso
-
Hidróxido de aluminio
-
Hidróxido mercurioso
-
Hidróxido cúprico
-
Hidróxido de niquel (II)
-
Hidróxido de plomo (IV)
-
Hidróxido de oro (III)
-
Dihidróxido de calcio
-
Tetrahidróxido de platino
-
Trihidróxido de cobalto
-
Hidruro ferroso
-
Hidruro niquélico
-
Hidruro estánnico
-
Hidruro mercúrico
-
Hidruro de cinc
-
Hidruro de sodio
-
Trihidruro de oro
-
Dihidruro de cobre
-
Tetrahidruro de estaño
-
Hidruro de cobre (II)
-
Hidruro de oro (I)
-
Hidruro de oro (III)
-
Hidruro de platino (IV)
-
Sulfuro de hidrógeno
-
Ácido sulfhídrico
-
Fluorurode hidrógeno
-
Ácido fluorihídrico
-
Seleniuro de hidrógeno
-
Ácido selenhídrico
-
Ácido carbónico
-
Ácido selenioso
-
Ácido perclórico
-
Ácido bromoso
-
Ácido metafosfórico
-
Ácido ortoantimonioso
-
Ácido silícico
-
Ácido hipobromoso
-
Ácido piroarsenioso
-
Ácido clórico
-
Ácido sulfúrico
-
Ácido teluroso
-
Ácido carbonoso
-
Clorito de cinc
-
Sulfato niqueloso
-
Bromato férrico
-
Perclorato platínico
-
carbonito de plata
-
Nitrito áurico
-
Silicato de potasio
-
Ortoantimoniato estannoso
-
Sulfuro niquélico
-
Cloruro cúprico
-
Nitrato ferroso
-
Piroarsenito áurico
-
Seleniuro mercurioso
-
Perbromato de cadmio
-
Bromuro de aluminio
-
Silicato ferroso
-
Ortoantimonito plúmbico
-
Pirofosfito estánnico
-
Selenito de potasio
-
Bisulfuro cobaltoso
-
Bicarbonato de potasio
-
Carbonato ácido de potasio
-
Biseleniato plúmbico
-
Ioduro áurico
-
Sulfuro platínico
-
Piroarsenito niquélico
-
Peryodato niqueloso
-
Hipobromito de calcio
-
Bisilicato de cinc
-
Yodito niqueloso
-
Bromuro de estroncio
-
Carbonito férrico
-
Sulfito ácido áurico
-
Trioxo carbonato (IV) de potasio
-
Heptaoxo di fosfato (V) de cobre (II)
-
Hidrógeno tetra oxo sulfato (VI) de aluminio
-
Penta oxo di antimoniato (III) de hidrógeno
-
Seleniuro de platino (IV)
-
Oxoclorato (I) de oro (III)
-
Dioxo nitrato (III) de aluminio
-
Nitrito de cinc
-
Dihidrógeno tetraoxo fosfato (V) de niquel (III)
-
Carbonato ácido de calcio
En los apartados anteriores se ha visto los procesos a seguir a la hora de formular un compuesto. Vamos ahora a ver los pasos a seguir para, dada una fórmula, nombrar el compuesto.
Para ello, nos basaremos en la tabla anterior, y lo primero que se debe analizar es por qué elementos está formado el compuesto a nombrar:
Fe2O3 Este compuesto está formado por un elemento y oxígeno, por tanto será un óxido.
Conviene, en primer lugar que se nombre siguiendo la nomenclatura sistemática pues en ella, simplemente habrá que leer el compuesto, de detrás hacia delante, incluyendo los subíndices. Como en nuestro caso hay tres oxígenos y dos hierros, el nombre será: trióxido de dihierro.
En las otras dos nomenclaturas (tradicional y de Stock) habrá que calcular la valencia del metal. Esto lo haremos siempre basándonos en que la molécula debe ser neutra, es decir, la suma de valencias + debe coincidir con la de valencias -.
Fe2 O3
3+ -2
+6 : 2 = 3+ (-2) x 3 = 6-
6+ 6-
El oxígeno actúa siempre con valencia 2 -. Al haber 3 oxígenos, el total de valencia negativas será de 6, por lo que deberá haber también 6+. Estas sólo las puede tener el hierro, y como hay dos átomos de hierro, a cada uno le corresponderá una valencia de 3+. Por tanto el nombre del compuesto será:
N. Tradicional: óxido férrico (pues el hierro actúa con la mayor valencia)
N. de Stock : óxido de hierro (III)
Cl2O7 N. Sistemática : Heptaóxido de dihierro (pues el compuesto está formado por 7 átomos de cloro y 2 de oxígeno)
Cl2 O7
+7 -2
(+14) : 2 = 7 (-2) x 7 = -14
+14 14-
N. Tradicional : óxido perclórico (anhídrido perclórico) (pues hay que tener presente que el cloro tiene 4 valencias positivas: la menor será = hipòcloroso, la siguiente = cloroso,
la tercera = clórico y la mayor = perclórico)
N. de Stock : óxido de cloro (VII)
No siempre la valencia del elemento coincidirá con el subíndice del oxígeno pues , en ocasiones, puede haber habido una simplificación, por lo que es aconsejable seguir siempre el método indicado. Interés que se incrementa al pensar que en el resto de los compuestos a analizar, el procedimiento será análogo.
Hg (OH)2 En este caso el compuesto es un hidróxido pues está formado por un metal y el grupo (OH).
En los hidróxidos no hace falta realizar operaciones para determinar la valencia del metal, pues, al no haber posibilidad de simplificación, el subíndice del grupo (OH), coincide con la valencia del metal. Por tanto, los nombres serán:
N. Sistemática : Dihidróxido de mercurio
N. Tradicional : Hidróxido mercúrico
N. de Stock : Hidróxido de mercurio (II)
Hg H2 En este caso el compuesto es un hidruro pues está formado por un metal y H.
En los hidruros no hace falta realizar operaciones para determinar la valencia del metal, pues, al no haber posibilidad de simplificación, el subíndice del H coincide con la valencia del metal. Por tanto, los nombres serán:
N. Sistemática : Dihidruro de mercurio
N. Tradicional : Hidrurodo mercúrico
N. de Stock : Hidruro de mercurio (II)
H2S Este compuesto es un hidruro de no metal (ácido hidrácido es disolución). Aquí tampoco hace falta comprobar las valencias pues el no metal sólo puede tener una valencia (la negativa) y el hidrógeno siempre actúa con valencia 1-.
N. Sistemática : Sulfuro de hidrógeno
N. Tradicional : Ácido sulfhídrico
H2CO3 Estamos ante un ácido oxácido en el que sabemos la valencia del hidrógeno (1-) la del oxígeno (2-) y nos falta saber la del no metal (en este caso el carbono) para saber si el ácido termina en oso o ico. Para determinarla seguiremos el mismo método que se ha seguido hasta ahora.
H2 C O3
+1 +4 2-
2 hid x (+1) 3 oxígenos x (2-) = 6-
+2 +4 6-
Como la suma total de valencias negativas es 6 (corresponden a los oxígenos), la suma de las valencias positivas deberá ser 6. Como los hidrógenos aportan 2, faltarán 4 que deberán ser aportadas por el carbono. Al ser 4 la valencia mayor, el ácido terminará en ico y su nombre será, ácido carbónico.
HIO4 Otro ácido oxácido del que deberemos saber la valencia del yodo para poder nombrar
Procederemos igual que en el caso anterior.
H I O4
+1 +7 2-
1 hid x (+1) 4 ox x (2-) = 8-
+1 +7 8-
Al ser la valencia del yodo 7, terminará en ico. Pero como el yodo puede tener hasta 4 valencias positivas, hay que ver el prefijo que se le pone. En este caso el per, con lo que su nombre será: ácido peryódico
H4P2O7 Estamos ante otro ácido oxácido, y procederemos igual que en los casos anteriores.
H4 P2 O7
+1 +5 2-
4 hid x (+1) 7 oxígenos x (2-) = 14-
+4 +10 14-
La valencia 5 del fósforo se obtiene al dividir las valencias positivas que tienen entre todo el fósforo presente, por el nº de átomos de él, es decir 10 : 2 = 5. Al ser 5 la mayor, la terminación del ácido será ico. Pero no hay que olvidar que los ácidos de fósforo, arsénico y antimonio (también algunos otro pero menos frecuentemente) suelen llevar el prefijo meta - piro - orto. para determinar el prefijo, una forma sería dividir el nº de átomos de hidrógeno presentes por el nº de átomos de no metal. El resultado puede ser 1, 2 ó 3. Si es 1 se le pone el prefijo meta. Si es 2 el piro (este también se puede saber pues se pone siempre que haya en la molécula dos átomos de no metal). Y si es 3, orto.
En nuestro caso, sabemos que es piro pues hay 2 átomos de fósforo o si lo
hacemos de la otra forma indicada tendremos:
Nº átomos de hidrógeno presentes = 4
Nº átomos de fósforo presentes = 2 4 : 2 = 2 piro
Por todo ello el nombre del compuesto será: Ácido pirofosfórico
CaCO3 Ahora estamos ante una sal ternaria proveniente de un ácido oxácido. En este caso la determinación de las valencias se complica pues puede suceder que no sepamos ni la del metal ni la del no metal por poder tener ambos más de una. Iremos complican- de forma sucesiva los ejemplos para evitar pegas.
Ca C O3
+2 +4 2-
1 x (+2) 3 oxígenos x (2-) = 6-
+2 +4 6-
El carbono actúa con la mayor, por lo que será un carbonato, en el caso del calcio no hay pegas pues el calcio sólo actúa con una valencia, en este caso 2+. Por todo ello, el nombre del compuesto será carbonato de calcio.
Al2(CO3)3 Este es un caso análogo al anterior pero en el que aparece un paréntesis. Podemos poner del nombre del compuesto carbon--- de aluminio quedando por determinar si termina en ito o en ato en función de la valencia que tenga el carbona.
El siguiente paso sería romper el paréntesis teniendo en cuenta que el subíndice que lleva el paréntesis actúa como un coeficiente en Matemáticas, es decir, afecta a todos los átomos que hay dentro del paréntesis. Por todo esto la fórmula será Al2C3O9.
A continuación procederemos de la misma manera que antes para determinar la valencia del carbono.
Al2 C3 O9
+3 +4 2-
2 x (+3) 9 oxígenos x (2-) = 18-
+6 +12 18-
El 4 de la valencia del carbono se obtiene de la misma forma ya vista es decir dividiendo el nº de valencias totales que deben llevar los átomos de carbono por el nº de átomos de este presentes es decir: 12 : 3 = 4
Por tanto el nombre del compuesto será: carbonato de aluminio
FeCO3 Nos encontramos ante una sal en la que hay dos elementos (el hierro y el carbono) que pueden tener más de una valencia. Viendo la fórmula podremos ya poner carbon...ferr...( con las terminaciones ito - ato para el carbon—y oso - ico para el ferr-)
En estos casos, hasta que se tenga un dominio suficiente de la formulación que nos permita saber casi “a ojo” las valencias del hierro y carbono, conviene probar con las dos valencias que puede tener el metal.
Fe C O3 Fe C O3
+3 +3 2- +2 +4 2-
+3 +3 6- +2 +4 +6
|
En este primer caso , sabemos de salida que la valencia del oxígeno es 2-, por lo qu el total de valencias negativas correspondientes a los átomos de oxígeno presentes será de 6-.
Supongo que el hierro actúa con valencia +3, por lo que se deduce que el carbono debe actuar con valencia +3, lo que no puede ser. Esto nos permite suponer que el supuesto no era adecuado.
|
|
Ahora actuamos de la misma forma pero suponiendo que la valencia con la que actúa el hierro es +2, con lo que se obtiene una valencia para el carbono de +4.
Al ser +4 para el carbono (la mayor) la terminación será ato, y al ser +2 para el hierro (la menor) la terminación será oso.
Por tanto el compuesto se nombrará como:
Carbonato ferroso
|
En el caso de que hubiera algún paréntesis se actuaría igual que en los casos anteriores, pero rompiendo el paréntesis de la forma ya explicada.
En las sales no se debe olvidar que se utilizan los prefijos (hipo - per y meta - piro - orto) de la misma forma que en los ácidos.
Ca(HS)2
Estamos ante una sal ácida pues vemos que parte del hidrógeno del ácido del que proviene, aún permanece. Esta no triene oxígeno. Aquí sabemos la valencia del hidrógeno (+1), del no metal (la negativa, en este caso 2-) por lo que nos resultará muy fácil, actuando como siempre, determinar la valencia del metal (en este ejemplo no hace falta pues el calcio sólo puede tener una valencia que es +2).
Por todo ello el nombre del compuesto será: bisulfuro de calcio o sulfuro ácido de calcio.
Fe(HCO3)3
Estamos ante otra sal ácida, pero en este caso cuaternaria, pues además del hidrógeno, también contiene oxígeno. Romperemos el paréntesis de la forma ya indicada y trataremos de buscar la valencia con la que actúa el hierro y el carbono.
Antes de romper el paréntesis conviene poner el nombre de lo que se sepa, es decir:
bicarbon--- ferr---.
Fe H3 C3 O9
Fe H3 C3 O9
+3 +1 +4 2-
+3 +3 +12 18-
Por tanto, y a tenor de las valencias obtenidas, el nombre del compuesto será: bicarbonato férrico o carbonato ácido férrico
CUADRO – RESUMEN PARA NOMBRAR COMPUESTOS INORGÁNICOS
|
Fórmula general
|
Familia (Función química)
|
Nomenclatura tradicional
|
Nomenclatura Sistemática IUPAC
|
Nomenclatura de Stock
|
Ea Ob
|
Óxido
|
|
Numeral óxido de numeral elemento
|
Óxido de elemento (val)
|
|
M (OH) a
|
Hidróxido
|
|
Numeral hidróxido de metal
|
Hidróxido de metal (val)
|
M Ha
|
Hidruro metálico
|
|
Numeral hidruro de metal
|
Hidruro de metal (val)
|
Ha NM
|
Hidruro de no metal
(en disolución acuosa a los hidruros de los grupos 16 y 17 del SP también se les conoce como ácidos hidrácido)
|
Ácido no metal hídrico
El no metal puede ser: F, Cl, Br, I, S, Se, Te
Para los hidruros de los grupos 13, 14 y 15 se admiten nombres vulgares
|
No metal uro de hidrógeno (para los hidruros no metálicos de los grupos 16 y 17 del SP)
Numeral hidruro de no metal (para los hidruros no metálicos de los grupos 13, 14 y 15 del SP)
|
Ha NMb Oc
|
Ácido oxoácido
|
oso
Ácido P no metal
ico
|
Numeral oxo numeral no metal ato (val) de hidrógeno
|
|
|
Ma NMb
|
Sal binaria
|
|
Numeral no metal uro de numeral metal
|
No metal uro de metal (val)
|
Ma NMb Oc
|
Sal ternaria (oxisal neutra)
|
ito
P no metal metal (val)
ato
|
Numeral oxo numeral no metal ato (val) de metal (val)
|
|
|
Ma Hb NMc Od
|
Sal ácida (cuaternaria)
|
ito
Num H no metal metal (val)
ato
ito
No metal R ácido metal (val)
ato
|
Numeral hidrógeno numeral oxo numeral no metal ato (val) de metal (val)
|
|
|
Ma Hb NMc
|
Sal ácida (ternaria)
|
oso
Bi no metal uro metal
ico
|
Hidrógeno no metal uro de metal (val)
|
|
|
P = prefijo (meta, piro, orto, hipo, per)
|
M = Metal
|
NM = No metal
|
E = Elemento
|
Val ≈ nº de oxidación
|
a, b, c, d = subíndices
|
|
R = prefijo (di, tri)
|
|
Están en desuso o se utilizan muy poco
|
|
|
Para nombrar los hidruros no metálicos de los grupos 13, 14 y 15 suelen también utilizarse nombres vulgares: NH3 amoniaco, H2O agua, CH4 metano ..
-
Catión.- Es un ion cargado positivamente (nos indica que tienen menos electrones de los que debiera tener en estado neutro). A la hora de nombrarlos basta anteponer la palabra ion o mejor catión, al nombre del elemento. Si puede adoptar varios estados de oxidación se recomienda utilizar la notación de Stock.
Ejemplo: K1+ catión potasio (en la tradicional sería ion potasio)
Fe3+ catión hierro (III) (en la tradicional sería ion férrico)
También puede haber cationes poliatómicos en los que se suele utilizar nombres vulgares NH4+ amonio H3O1+ ion oxonio
Ejemplo: Cl1- ion cloruro S2- ion sulfuro
También puede haber aniones poliatómicos que proceden de los oxoácidos cuando se les quita hidrógeno. En la nomenclatura tradicional se cambia la terminación oso o ico por la de ito o ato y en la sistemática es como en los oxoácidos quitando la palabra hidrógeno
Ejemplo: NO31- ion nitrato (en la tradicional) ion trioxonitrato (V) (en la sistemática)
SO32- ion sulfito ion trioxosulfato (IV)
Ejemplo: H2O2 Peróxido de hidrógeno (Stock) Dióxido de dihidrógeno (sisteematizada) Agua oxigenada (vulgar)
FeO2 Peróxido de hierro (II) Dióxido de hierro
-
El cromo y el manganeso.- Los metales de transición de los grupos 5,6 y 7, y en especial el cromo y el manganeso, presentan estados de oxidación muy altos, incluso llegándose a comportar como no metales pudiendo formar oxoácidos. El Cr puede actuar como (+2, +3 y +6) y el Mn (+2, +3, +4, +6, +7).
|
FÓRMULA
|
Nomenclatura tradicional
|
Nomenclatura sistemática
|
|
H2 Cr O4
|
Ácido crómico
|
Tetraoxocromato (VI) de hidrógeno
|
|
H2 Cr2 O7
|
Ácido dicrómico
|
Heptaoxodicromato (VII) de hidrógeno
|
|
H2 Mn O3
|
Ácido manganoso
|
Trioxomanganato (IV) de hidrógeno
|
|
H2 Mn O4
|
Ácido mangánico
|
Tetraoxomanganato (VI) de hidrógeno
|
|
H Mn O4
|
Ácido permangánico
|
Tetraoxomanganato (VII) de hidrógeno
|



