EJERCICIO RESUELTO
- Para fabricar un anillo de plata de ley 925, un joyero emplea 15,73 g de plata pura y 1,27 g de cobre. Calcula el tanto por ciento en masa de soluto en dicha aleación.
We use cookies to improve and analyse your browsing experience on our web. You can accept these cookies, reject them or choose your settings by clicking on the corresponding buttons. Please note that rejecting cookies may affect your browsing experience. For more information you can consult our Cookies policy.
Cookies are an essential part of how our web works. The main goal of cookies is to make your browsing experience more comfortable and efficient and to improve our services and the web itself.
Here you can find all the information about the cookies we use and you can activate and/or deactivate them according to your preferences, except for those cookies that are strictly necessary for the operation of the web. Blocking some cookies may affect your experience on the web and how the site works. For more information you can visit our Cookie Policy.
These Cookies are necessary for the web to function and cannot be disabled on our systems. They are generally only set up in response to actions you may take such as requesting services, setting your privacy preferences, logging in or completing forms. You can set your browser to block or warn you about these cookies, but some parts of the web will not work. Information about Cookies.
These Cookies allow us to count the number of visits and traffic sources so that we can measure and improve the performance of our site. They help us to find out which pages are the most popular and least popular, and to see how visitors move around the web. All information collected by these Cookies is aggregated and therefore anonymous. If you do not allow these Cookies we will not know when you visited our web. Information about Cookies.
These cookies are used to analyse your activity in order to show you personalised advertisements. Information about Cookies.
Change theme

Revision mode

Algunas mezclas no son fáciles de reconocer, ya que no podemos distinguir dónde está cada sustancia. Sin embargo, si queremos comprobar si el azúcar sigue en el agua tan solo tendremos que probarla: apreciaremos el sabor dulce. Se trata, por tanto, de una mezcla homogénea.
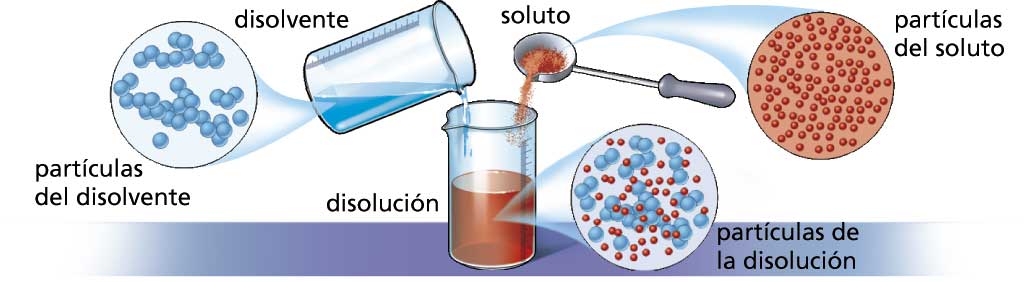
En este ejemplo decimos, por tanto, que el azúcar se ha disuelto en el agua, razón por la cual las mezclas homogéneas también reciben el nombre de disoluciones. En las disoluciones, las partículas de todas las sustancias se entremezclan tan bien que resulta imposible distinguirlas.
Todas las disoluciones constan de dos componentes:
El soluto y el disolvente pueden encontrarse en cualquier estado de agregación. Lo más habitual es que el disolvente se encuentre en estado líquido. El más usual es el agua, en cuyo caso se habla de disoluciones acuosas. Sin embargo, también es frecuente encontrar el soluto tanto en estado sólido como líquido o gaseoso. Algunos ejemplos son:

| Soluto | Disolvente | Ejemplo |
|---|---|---|
| Sólido | Líquido | Agua con azúcar |
| Líquido | Líquido | Alcohol con agua |
| Gas | Líquido | Bebidas gaseosas |
Aunque estamos acostumbrados a ver disoluciones líquidas, también es posible encontrar otras en las que el disolvente no es líquido:


Actividad 14
Actividad 15
Analiza la etiqueta de una botella de agua mineral de cualquier marca. ¿Qué solutos contiene?
Actividad 16
Nombra dos ejemplos de disoluciones no líquidas.
Actividad 17
Para trabajar con las disoluciones suele ser necesario conocer la proporción de soluto y disolvente, es decir, necesitamos conocer su concentración.
Hay muchas maneras de expresar una concentración, pero una de las más sencillas y utilizadas es el tanto por ciento en masa o porcentaje en masa:
No es obligatorio trabajar en gramos. Tan solo hay que tener cuidado y utilizar las mismas unidades de masa para numerador y denominador.
Puesto que se trata de un porcentaje, el resultado no tendrá unidades.

EJERCICIO RESUELTO
Actividad 18
Calcula la masa de ácido acético presente en 10 g de un vinagre comercial cuya etiqueta marca un porcentaje en masa del 6 %.
Otra de las formas más comunes de expresar una concentración relaciona la cantidad de soluto con el volumen de la disolución:
Recuerda la relación existente entre unidades de capacidad y de volumen:
Por tanto:
1 dm3 equivale a 1 L
EJERCICIO RESUELTO
Actividad 19
Calcula la concentración en g/L de una disolución que contiene 7 g de una sustancia pura en medio litro de agua.
Actividad 20
¿En cuántos litros de agua tendríamos que disolver 100 g de sal para conseguir una disolución cuya concentración sea de 5 g/L?
Actividad 21
¿Qué concentración en masa tendrá una disolución preparada a partir de 12 g de cloruro de potasio y 300 cm3 de agua?
Actividad 22
Calcula el tanto por ciento en masa de una disolución de azúcar en agua si contiene 30 g de soluto en 600 g de agua.
Actividad 23
Sabemos que el porcentaje en masa de yoduro de sodio en una disolución es del 8 % ¿Cuántos gramos de yoduro de sodio habrá disueltos en 75 g de disolución?
El procedimiento consta de los siguientes pasos:
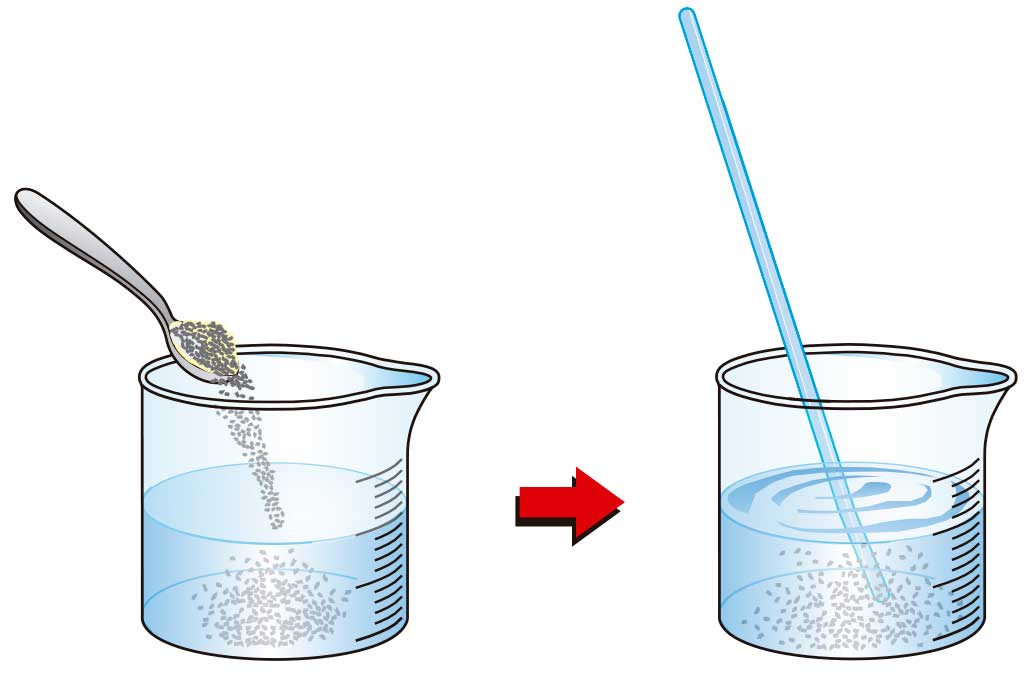

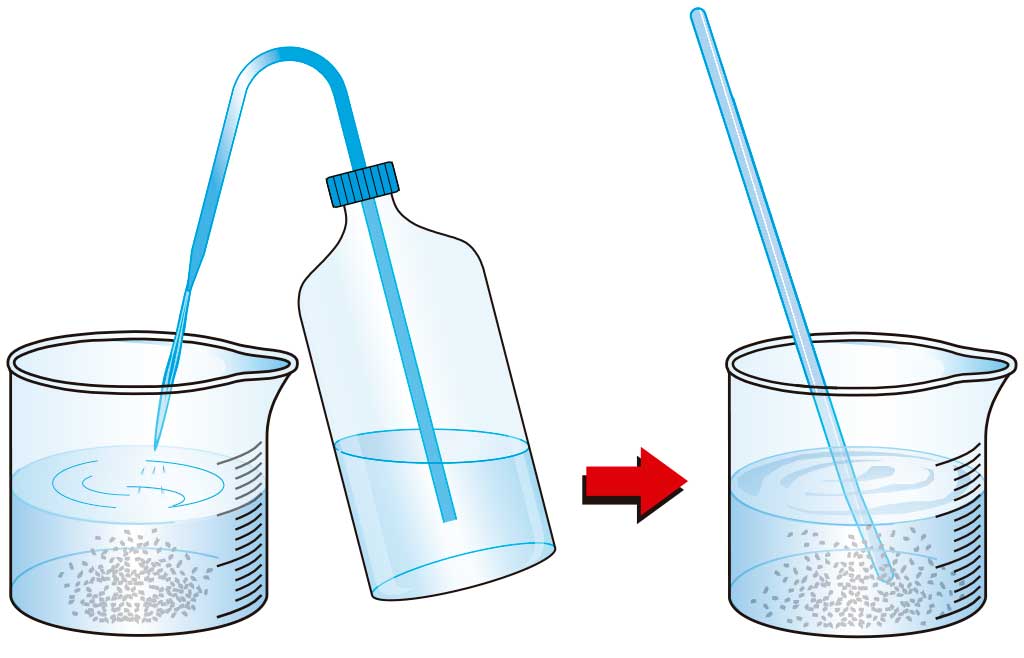
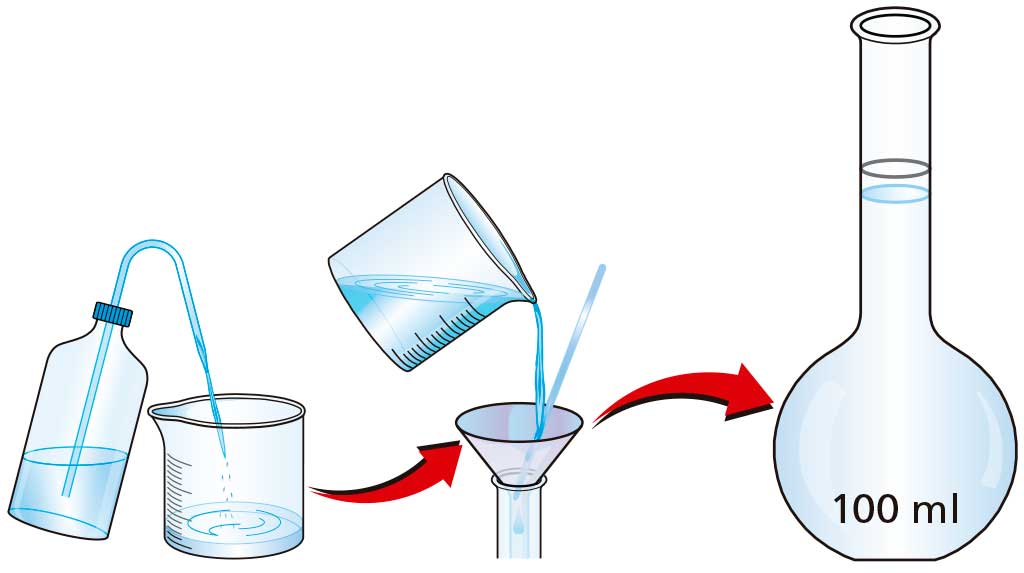
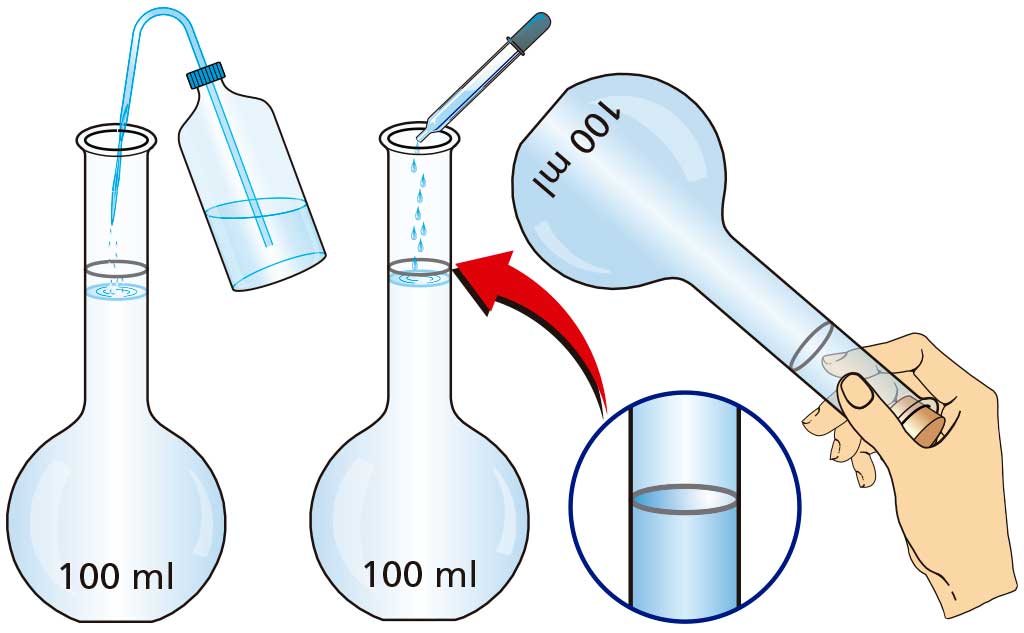
Cuando se mezclan dos sustancias formando una disolución, las partículas del sólido abandonan sus posiciones originales y se distribuyen entre las del disolvente; de esta manera, las partículas de soluto pasan a ocupar posiciones en las que antes solo había partículas de disolvente.
Actividad 14
¿Sería la plata usada por los joyeros una sustancia pura o una disolución? ¿Y las monedas de 1, 2 y 5 céntimos de euro? Investígalo.
Actividad 17
Busca información sobre la mezcla de gases que forman el gas natural.

