Valoraciones o volumetrías de neutralización ácido-base
Una de las ramas más importantes de la química es la denominada química analítica, que se encarga del análisis y cuantización de muestras. Dado que la variedad de muestras es casi infinita, el número de técnicas que se pueden utilizar es muy elevado, pero muchas de ellas poseen un paso en común: la valoración o volumetría.
Entendemos como
proporción estequiométrica al cociente entre el número de moles del compuesto y la estequiometría del mismo en la reacción química.
La valoración o volumetría es el método analítico que permite definir la cantidad de reactivo presente en una muestra a partir de la determinación del momento en que ha reaccionado completamente con una cantidad conocida de otro reactivo, instante que se conoce con el nombre de punto de equivalencia.
subtitulo
- En esta ocasión vas a determinar el contenido en ácido acético (CH3COOH) del vinagre comercial mediante valoración con sosa o hidróxido de sodio (NaOH).
Material: vinagre comercial, hidróxido de sodio (NaOH) e indicador de pH (fenolftaleína).
- Para ello, tomarás una cantidad conocida de vinagre y la harás reaccionar con una disolución de sosa hasta que encuentres el momento en que han reaccionado totalmente:
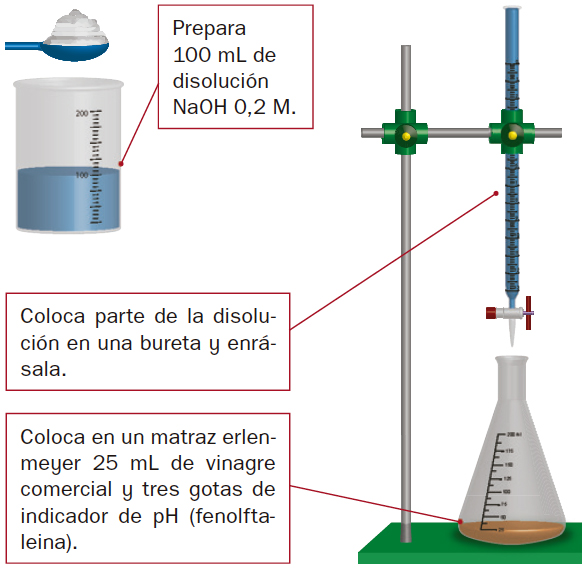
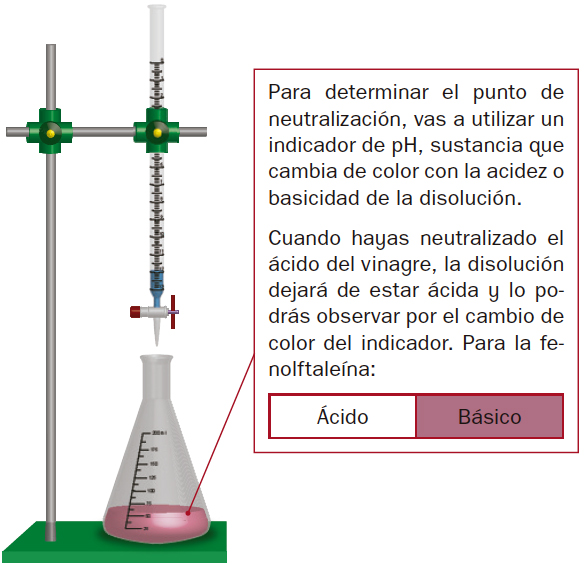
Debes ir añadiendo la sosa poco a poco hasta llegar al punto de equivalencia.
NOTA: suele ser interesante realizar una primera valoración rápida para tener una idea del valor aproximado de volumen que se obtiene. Una vez identificado este, se realiza la segunda valoración añadiendo base hasta las proximidades del punto final y después, gota a gota.
|
|
|
- En el punto de equivalencia o valoración, las cantidades de reactivos están en proporción estequiométrica, es decir, ninguno de los dos está en exceso.
En ese instante se observa que la proporción estequiométrica es la misma para ambos compuestos:
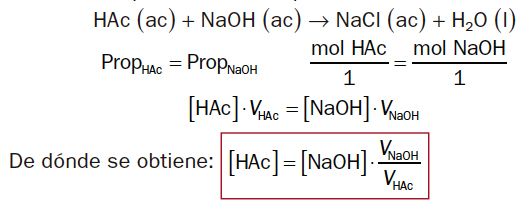
|
|
- Realiza la determinación en tres ocasiones y toma el valor medio de la concentración como el valor real. Compara la concentración que has obtenido con la acidez que indica la etiqueta (el grado de acidez indica masa (g) de acético por 100 mL de vinagre).
- Determina el error absoluto y relativo de cada una de tus medidas y analiza la exactitud de tu resultado.
B. Transferencia de iones: precipitación
Se denominan reacciones de precipitación aquellas reacciones que transcurren en disolución (generalmente acuosa) y en las que se genera un producto insoluble en fase sólida que enturbia la disolución o se deposita en el fondo.
subtitulo
- Lluvia de oro. Prepara una disolución de nitrato de plomo (Pb(NO3)2) y otra de yoduro de potasio (KI), disolviendo 0,1 g de cada sal en 100 mL de agua. Vierte una sobre otra y analiza el resultado. Nota: el resultado posee plomo, que es contaminante, y no debes tirarlo por la pila ni a la basura; tu docente te indicará cómo actuar.
Repite el experimento, pero mezclando las sales directamente en un mortero. Escribe y ajusta la reacción que ha tenido lugar en este caso.
- ¿Tiene cloruros el agua que bebes? La presencia de cloruros es habitual en el agua para consumo. ¿Cómo demostrarlo? Toma cuatro tubos de ensayo y añade, en el primero de ellos, 3 mL de agua destilada; en el segundo, agua mineral embotellada; en el tercero, agua del grifo y, en el último, agua de una fuente natural. Añade directamente en todos ellos una punta de espátula de nitrato de plata (AgNO3).
¿En qué tubo de ensayo aparece un precipitado, qué producto se ha formado y qué información extraes de ello? Este ensayo puede dar positivo con otros iones, ¿cuáles pueden ser?
- Humo de la nada. Toma dos probetas de 100 mL o dos matraces aforados de igual volumen. En una de ellas coloca unas cinco gotas de ácido clorhídrico comercial y, en la otra, cinco gotas de amoniaco comercial. Tápalas con un poco de algodón y espera unos minutos. Dentro de la campana extractora de gases destápalas y vierte simultáneamente su contenido gaseoso sobre un vaso de precipitados de 500 mL. ¿Qué observas?
Escribe y ajusta la reacción que ha sucedido, teniendo en cuenta que hemos combinado un ácido con una base. ¿Qué sucedería si la reacción se hiciera mezclando directamente los reactivos disueltos en agua (1 mL en 100 mL de agua)?
- Detectando CO2. Añade a 50 mL de agua la cantidad suficiente de hidróxido de calcio (Ca(OH)2) hasta llegar a saturarla y, a continuación, fíltrala para obtener una disolución transparente y limpia. Con una pajita, sopla suavemente a través de la disolución. La aparición de un precipitado muestra la existencia de CO2 en el aire que exhalamos.
Identifica, escribe y ajusta las reacciones consecutivas que han sucedido. ¿Qué tipo de reacción ha tenido lugar?
- Aparece y desaparece. Disuelve 0,1 g de sulfato de cobre en 100 mL de agua y coloca 4 mL de esta disolución en un tubo de ensayo. Disuelve 0,1 g de hidróxido de sodio en 50 mL de agua y guárdalo en una botella con cuentagotas. Deja caer una gota de la disolución de hidróxido sobre la de cobre. ¿Qué observas? Ahora añade 10 gotas más. ¿Qué ha sucedido? ¿Cómo se llama este proceso? Identifica, escribe y ajusta las reacciones que han tenido lugar.
A partir de los cinco experimentos, ¿qué conclusión obtienes sobre la fase de los reactivos en relación con la aparición de un precipitado?
Algunas aplicaciones de las reacciones de precipitación son:
- Detección de determinados iones. Si se añade el contraión adecuado, la aparición de un precipitado indica la presencia del ion, como en el caso de detección de CO2 o de cloruros en las aguas, o en el caso de determinar la presencia de cobre.
- Eliminación de un determinado ion mediante la formación de una sal insoluble que, posteriormente, se retira por filtración, centrifugación o decantación.
C. Transferencia de electrones: redox
Acabamos de estudiar las reacciones en las que se intercambian cargas positivas, como los protones en ácido-base. En esta ocasión, el intercambio será de cargas negativas en forma de electrones, lo que origina dos comportamientos:
Se puede recordar fácilmente el proceso de oxidación a partir de la oxidación del hierro metálico.
Fe ( s ) → Fe2+ ( ac ) + 2 e−
Fe ( s ) → Fe3+ ( ac ) + 3 e−
Oxidación → perder e−
| Oxidación |
Reducción |
| Proceso en el que una sustancia pierde electrones.
Zn ( s ) → Zn2+ ( ac ) + 2 e−
|
Proceso en el que una sustancia gana electrones.
Cu2+ ( ac ) + 2 e− → Cu ( s )
|
Como observarás, los procesos deben suceder de manera simultánea: alguien debe perder electrones para que otra sustancia los pueda ganar. Esto permite definir el proceso redox como dos semirreacciones, una de reducción y otra de oxidación:
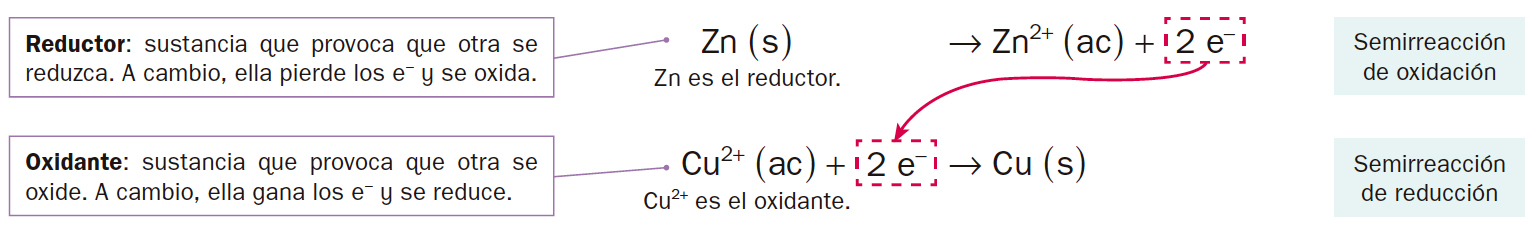
Las aplicaciones de los procesos redox son muy numerosas. Veamos algunas de ellas:
- Deposición de metales nobles: utilizando el reductor adecuado, es posible conseguir la formación de una capa de un metal noble (Au, Ag, incluso Cu) sobre un cuerpo a partir de una disolución de alguna de sus sales.
- Decapado: es el caso opuesto al anterior, la eliminación de un metal.
- Protección catódica: consiste en introducir en el sistema una sustancia que se oxide antes de la que queremos proteger. Un ejemplo es el uso de barras de magnesio en el interior de los calentadores eléctricos. Este metal se oxida antes que el hierro que forma la carcasa metálica, por lo que esta está protegida.
- Procesos biológicos, como la fotosíntesis, poseen una cadena bastante compleja de procesos redox que permiten transportar la energía luminosa del sol y convertirla en energía química. La respiración hace el ciclo inverso para aprovechar la energía química y convertirla en movimiento, reparación celular, etc.
- El intercambio de electrones producido en los procesos redox se puede aprovechar y transferir por un conductor eléctrico. Tan solo hay que separar las dos semirreacciones con un tabique poroso o en dos recipientes independientes. En este último caso hay que cerrar el circuito eléctrico con un puente salino que permita el flujo de cargas en forma de iones.
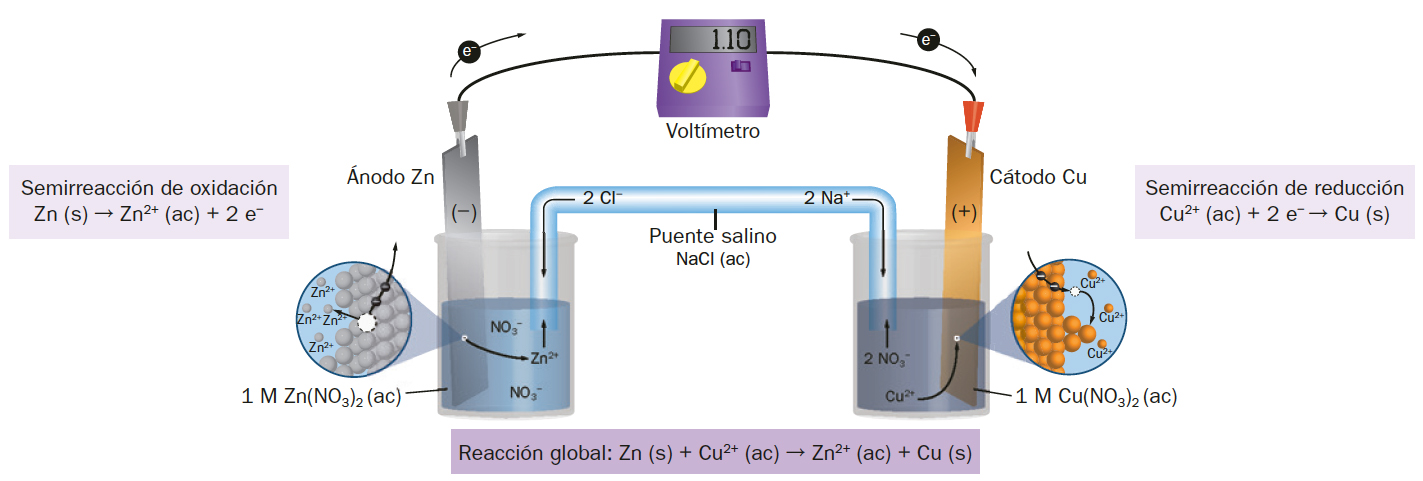
subtitulo
Vas a construir una de las primeras pilas de las que se tiene constancia; se trata de una variación de la pila de Daniell. Toma diez monedas de 5 céntimos cada una, diez trocitos cuadrados de papel de aluminio de unos 1,5 × 1,5 cm, similares al tamaño de la moneda. Prepara nueve trozos de cartón o papel de unos 2 × 2 cm, algo mayores que la moneda y los trozos de aluminio, y humedécelos totalmente con una disolución de agua salada o con vinagre.
Tienes un interesante vídeo sobre el funcionamiento de la pila de Daniell a nivel atómico en las siguientes direcciones:
bit.ly/Pila_Daniell_video
Monta ahora el sistema de la figura alternando las capas de los componentes. Une el cable que sale de la moneda al polo negativo de un LED y el cable que sale del papel de aluminio al polo positivo. Busca y analiza la reacción que sucede en este caso.

La combustión
Exotérmico: proceso fisicoquímico que desprende energía.
Endotérmico: proceso fisicoquímico que absorbe energía.
Una de las reacciones químicas que más ha influido en la historia de la humanidad pertenece a los procesos redox y corresponde a las combustiones: nos permitió calentarnos, protegernos de los depredadores y, sobre todo, cocinar los alimentos para que fueran más digeribles; además, posibilitó a la humanidad el descubrimiento de la metalurgia y la transición de la Edad de Piedra a la de los Metales.
Cualquier combustión es un caso particular de proceso redox entre un combustible (que se oxida) y un comburente (que actúa como oxidante), acompañado de emisión de energía en forma de luz y, sobre todo, de calor. Se concluye, por tanto, que las combustiones son procesos exotérmicos.
En la combustión del carbón (esencialmente carbono) o del Mg de una bengala, tenemos:

subtitulo
-
 En parejas, ajustad e identificad en las siguientes reacciones el oxidante, el reductor, qué sustancia se oxida y cuál se reduce. Clasificadlas de acuerdo con el criterio de estructura. Al terminar, uníos con otra pareja y compartid sus conclusiones y exponedlas en el aula. Ganará quien cometa menos errores.
En parejas, ajustad e identificad en las siguientes reacciones el oxidante, el reductor, qué sustancia se oxida y cuál se reduce. Clasificadlas de acuerdo con el criterio de estructura. Al terminar, uníos con otra pareja y compartid sus conclusiones y exponedlas en el aula. Ganará quien cometa menos errores.
- Cu (s) + O2 (g) → CuO (s)
- H2 (g) + O2 (g) → H2O (g)
- H2O2 (l) → H2O l) + O2 (g)
- Na (s) + Cl2 (g) → NaCl (s)
- Los metales activos son aquellos que reaccionan con los ácidos y producen hidrógeno. Determina la riqueza en cinc de una mezcla sabiendo que, a partir de 5 g, se han recogido 50 mL de hidrógeno medido a 20 ºC y 650 mmHg.
Zn (s) + HCl (ac) → ZnCl2 (ac) + H2 (g) ↑
S: 2,33 %
